化学電池の中でも、一次・二次電池と言うのは最もポピュラーな種類です。
一次電池と言うのは充電できない電池の事で、市販されている乾電池などがこれにあたります。一方、二次電池は充電できる電池で、ニカド電池やニッケル水素電池、リチウムイオン電池なども二次電池です。
分類するのは簡単ですが、これらがどうして充電できたり出来なかったりするのかについてはよく知られていません。実は、一次電池でも充電自体は出来るのですが、充電するために作られた二次電池との間には、大きな違いがあります。
電気を作る電池(化学電池)のしくみ
一般的に使われている電池の殆どが一次・二次電池に分類され、これらは全て「化学電池」と呼ばれる種類の電池です。
この化学電池と言うのは、物質の化学的特性を利用して発電する電池の事を指します。要は、化学反応を利用して電気を取り出している電池の事です。
「電気を取り出す」と言うのは、主に電気を流して電流を作ると言う意味ですが、電流というのは電子の移動の事を指しています。つまり、電池は何らかの方法で電子を移動させる能力を持っているということになるのです。そして、注目するべきは化学反応の多くが電子のやりとりを伴うという点。
電子のやりとりを上手くコントロールして、電子が増える方と減る方を用意してやれば電流は生まれる事になりますね。
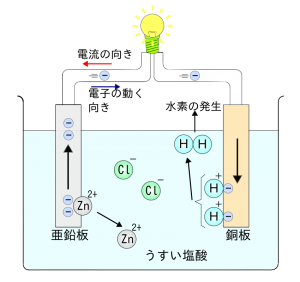
そして、電流が流れる化学反応を理解する上で大切なのが、物質の電気的特性です。上はボルタ電池が電気を発生させる際の図です。
一般的な電池は、主に「陽極(プラス)」「陰極(マイナス)」「電解液」で構成されます。陽極はその名の通りプラスの電気を持っていて、陰極はマイナスです。また、電解液と言うのは化学反応を促す物質で、多くの場合液体です。
この三種類の物質が上手く絡み合って電気が流れるのですが、この図の場合は陽極が銅板、陰極が亜鉛板になり、電解液は塩酸ということになります。電流の向きと電子の動きは真逆になるので気を付けましょう。
上図の反応を簡単に説明すると、うすい塩酸の中に亜鉛板と銅板が導線に繋がれて塩酸に浸されると、塩酸の塩素イオン(Cl)が亜鉛板から亜鉛(Zn)を奪ってZnCl2を作るのですが、その際に亜鉛が持っていた電子2つが亜鉛板に置き去りにされます。そして、銅板では塩酸の水素イオン(H)が、銅板の電子を2つ奪って水素(H2)を作ろうとします。
この反応が起こると、亜鉛板に電子が余ってマイナスになり、銅板に電子が足りなくなってプラスになります。すると、マイナス側から電子がプラス側に流れることで、電子の流れ(電流)が生まれるのです。
電池は陽極・陰極・電解液で決まる
先ほどの例から分かるように、陰極側で電子が余るような反応が起こり、陽極側で電子が減るような反応が起こらなければ電池にはなりません。
放っておいてもその反応が起こるなら良いのですが、普通はそんなことは起こりませんので電解液を使って反応が起こるような環境を作ります。また、ボルタ電池の場合は電気が流れないようにスイッチを切っても少しずつ銅や亜鉛が塩酸で溶けていきますので、長時間使うような電池には使えません。
実用的な電池を作るためには、電子が沢山余る陰極素材と、電子が沢山減る陽極素材、スイッチを入れた時だけ反応が起こるような電解液が必要になるということです。陰極でより沢山電池が余れば、陽極により沢山の電池が流れる事になり、電池のパワーが増すのです。
そこで、電池の性質を分けるのが、極に使われる金属の「イオン化傾向」です。
イオン化と言うのは元素に含まれる電子が減って「イオン」になる現象のことですが、イオン化傾向が強いほどこの現象が起こりやすい金属ということが出来ます。
基本的には、陰極側にイオン化傾向の強い金属を使い、陽極側にはイオン化傾向の小さい物を使うのが基本です。
ちなみに、イオン化傾向のリストは以下の通り。
<イオン化しやすい>
リチウム
カリウム
カルシウム
ナトリウム
マグネシウム
アルミニウム
マンガン
亜鉛
鉄
カドミウム
ニッケル
スズ
鉛
銅
水銀
銀
白金
金
<イオン化しにくい>
金や銀などは滅多にイオン化せず、イオン化させるには逆にエネルギーを投入する必要があります。その一方でリチウムやカリウム等は、水に付けておくだけでもイオン化してしまうほどイオン化しやすい金属です。
ただし、これは一次電池の場合で、二次電池の様に充電を想定されている電池の場合は、リチウムイオンバッテリーのように初めから「イオン化」した物質を使って、イオン自体に電子のやりとりをさせることもあります。というのも、充電時には電圧を逆に向きに掛けて、元の状態に戻すのですが、イオン化したものを元の金属に綺麗に戻すのは困難であり、予期せぬ反応が起こる可能性が高いからです。または、金属そのものをイオン化させるのではなく、水酸化イオンなどをつかって金属自体がイオン化しないようにしています。
また、イオン化傾向の差が大きければ大きいほど電池の電圧が高くなるという特徴もあり、リチウムと亜鉛では3倍程度電圧に差がでることになります。