燃料電池車がにわかに話題になっていますが、燃料電池の「燃料」とはいわゆる水素の事。もちろん、水素以外にも使える燃料電池に使える燃料は沢山あるのですが、どんな燃料を使ってもそれは水素を含んでいて、最終的に発電しているのは水素です。
さらに、水素で発電すると水が発生するというのですが、水素は燃やしても水になります。水素による発電は電気分解の逆の反応と説明される事がありますが、そもそも水素で発電するのと燃焼させるのでは一体何が違うのでしょうか?
水素を燃やすと何が起こるか?
水素(H)というと元素の中で最も軽い元素で、陽子が一つ、電子が一つの元素です。空気中では水素元素が2つ並んだ水素分子(H2)として存在し、燃焼反応では同じく酸素元素が2つ並んだ酸素分子(O2)と反応して水(H2O)になります。
しかし、水素を空気中に開放しただけでは燃焼反応は起こらず、火を付けた時だけ反応が起こるのは何故でしょう?
実は、水素の燃焼反応時には熱や光や電気によって分離した原子や分子が関わっていました。
 (水素の燃焼反応_MELScience)
(水素の燃焼反応_MELScience)
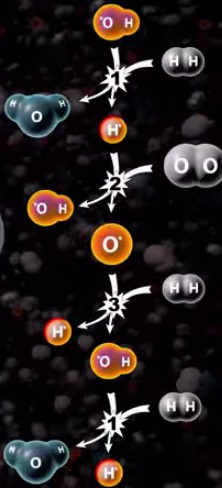
上図は水素の燃焼反応をシュミレートしたものです。
見ると分かるのですが、水素分子と水酸分子が最初に反応しています。その後で水素原子が生まれ、酸素と反応して新たな水酸化分子が生まれています。
水素の燃焼を化学式で書くと、
「2H2 + O2 → 2H2O」となる反応ですが、
この反応の中身はこれです。
①「OH・ + H2 → H2O + H・」
→ ②「H・+ O2 → OH・ + O・」
→ ③「O・ + H2 → OH・ + H・」
→ 「②と①へ」
これは連鎖反応と呼ばれるもので、「OH・」や「H・」や「O・」は外から来たエネルギーによって分離してしまった分子や原子で、「ラジカル」と呼ばれる不安定な物質です。電気的な極性を持った「イオン」のことを示す場合もあるのですが、水の燃焼時には電気的な極性は無関係です。また、記号の上に付いている「・」は、分離(遊離)してしまった原子や分子のことを示しています。
③の反応などは「水になるんじゃねえのかよっ!」と突っ込みたくなりますが、エネルギーが大量に提供されている時(燃焼中や爆発時)には水になりません。全体の反応が収束してくる段階になってようやく③の反応が水になり、反応が終わっていきます。つまり、③が水になり始めたら燃焼反応自体が終わります。
「①のOHはどこから来た?」と疑問に思うかもしれませんが、実際には②あたりから反応が始まっています。水素に熱や光や電気を加えてエネルギーを与えると、水素分子が分離して水素原子(水素ラジカル)が生まれ、酸素と反応することで最初の反応が起こります。上の反応を見るとわかりますが、②や③で原子や分子が分離しまくっているので、水素や酸素がある限り燃料反応が爆発的に進んでしまうのです。
ちなみに、これらの反応の全てで大きな熱エネルギーが発生していますが、電気的なエネルギーはこれでは発生しません。つまり、水をそのまま燃焼させるだけでは電気は生まれないということです。
水素発電の鍵はイオン化にあり(PEFC方式)
(燃料電池の仕組み_IWATANI)
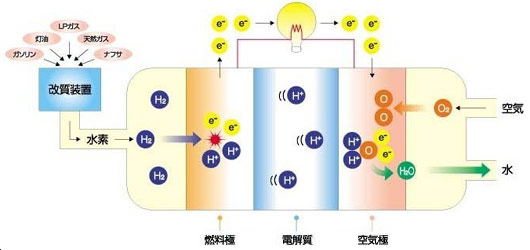
水素の燃焼では、水素を分離させて水素原子(水素ラジカル)を作って燃焼反応を起こしていましたが、水素で発電するためには水素に電気的な性質を持たせて「イオン化」させる必要があります。
上図は固体高分子形燃料電池(PEFC)と呼ばれる方式で、水素を燃料極でイオン化し、イオン化の際に放出される電子を空気極に運び、酸素と反応させる事で電子を回収しています。燃料電池車などに搭載されているのもこの方式です。
電池のしくみにもこれに近い方法が使われていますが、重要なポイントは「電子を作り、誘導・発電し、回収する」ためのシステム作りにあります。
発電というのは電位差が生じた際の電子の移動によって引き起こされますが、左から右に電子が移動すればそのうち右に電子が溜まって左の電子が減ります。そうすると、今度は左右の電位差が無くなって電子が動かなくなります。そのため、左から右に電子を動かし続けたい場合は、「左で電子を作り、右に集まった電子を回収する」必要があるのです。
また、それと同時に左でイオン化した水素イオンを電子のある右側に誘導することで酸素と反応するきっかけを作ってやり、水素イオン+酸素+電子の3つが揃うことで反応が起こります。
この時の反応で熱が多少発生するのですが、電子を遠回りさせる際に電子が持っていたエネルギーを電気的なエネルギーとして回収してしまっているため、電子のエネルギーは極めて小さい状態です。そのため、普通の燃焼のように強い反応は起こりません。電子が綺麗に流れる道筋を作ってやるだけで発電装置と化してしまうのは面白いところですね。
(次ページ: 全く逆のルートを辿るSOFC方式)



